研究内容
(1)Eph receptor A2 (EphA2)のプロセシングを介したがん悪性化進展制御の分子機序の解明とがん診断法への応用
Eph receptor A2 (Erythropoietin producing hepatoma receptor-A2: EphA2)は、腫瘍の悪性化進展に伴いその発現を亢進し、がん特異的な発現を示すことからがん治療の標的分子と見なされています。現在までに、EphA2のチロシンリン酸化の阻害化合物を用いた臨床試験が行われましたが、これまでに有効な抗腫瘍効果は見いだされていません。この原因として、EphA2が受容体としてがん化を相反するシグナルの制御に関与することがあげられます。がん化を促進するEGF受容体(EGFR)と異なり、EphA2はリガンド存在下では、それに依存したチロシン残基のリン酸化(pY588)を介してがん抑制に作用します(図4右)。一方、リガンド非存在下では、EphA2はEGFR下流シグナルと共益してセリン残基のリン酸化(pS897)を誘導してがん化促進に働きます(図4左)。これら対照的な機能はリガンド発現の有無で制御されると考えられていましたが、最近、リガンドのEphrin-Aは可溶化型として腫瘍や正常組織から多量に産生される、特に、がん血清には高濃度に存在することが明らかとなりました。そのため、腫瘍細胞が悪性形質を獲得するためには、生体内にユビキタスに発現しているEphrin-Aによるリガンド依存的ながん抑制シグナルからの回避が必須となり、EphA2によるがん化促進の分子メカニズムを正確に理解することが新たなEphA2を分子標的とした治療法の開発には必須であります。
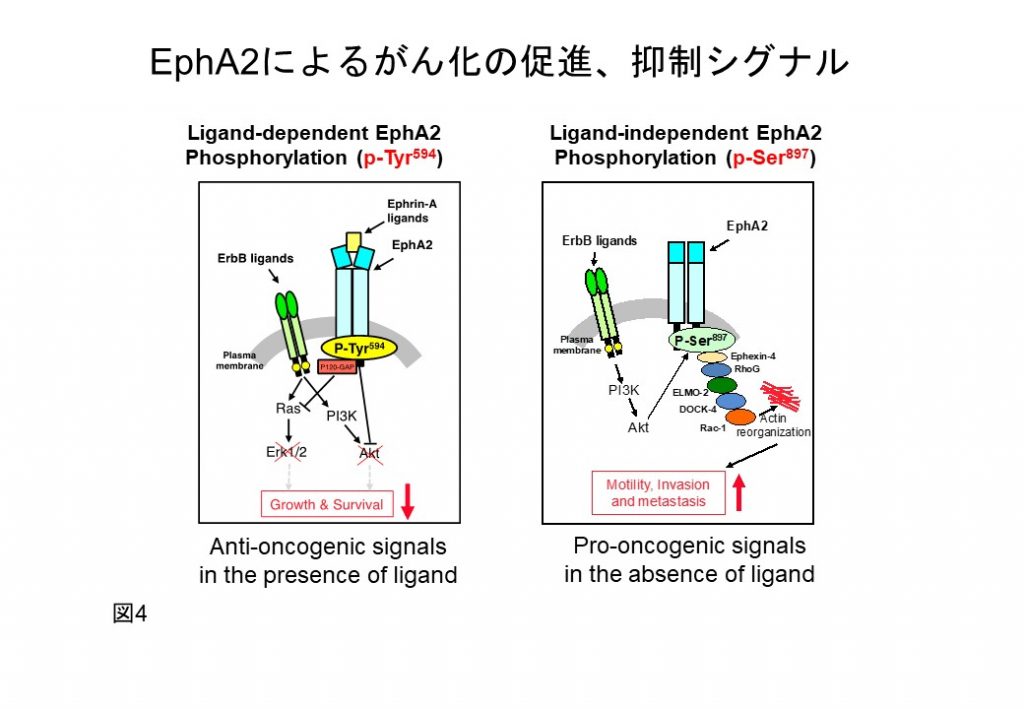
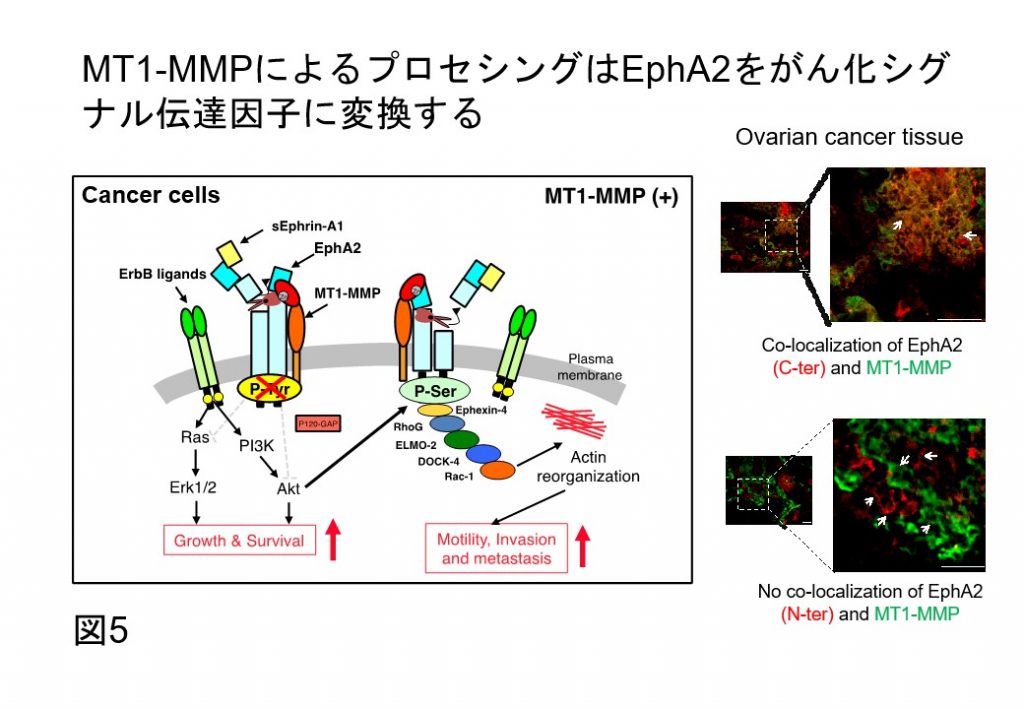
これまでに私たちは、膜型メタロプロテアーゼ(MT1-MMP)がEphA2と細胞表層で相互作用すること(Cancer Sci 2008)、そのN末端のリガンド結合部位を部分切断(プロセシング)し、リガンド結合部位を欠損したEphA2断片に遊離すること(Cancer Res 2015)(図4)、さらに、遊離したEphA2のN末端断片が悪性がん患者血清に高濃度に存在することを見出しています(Cell Death & Diseases 2017)。これらは、悪性腫瘍細胞の膜上では、N末端を欠損したEphA2断片が安定的に発現し、がん化促進シグナルの伝達因子(トランスミッター)として働くことを強く示唆しています(図5)。以上より、MT1-MMPにより産生したEphA2断片の悪性化進展の分子制御基盤に立脚した独創的な創薬シーズ開発の基盤構築行っております。
(2)がん特異的に発現するラミニンγ2単鎖を指標としたがん診断法の開発
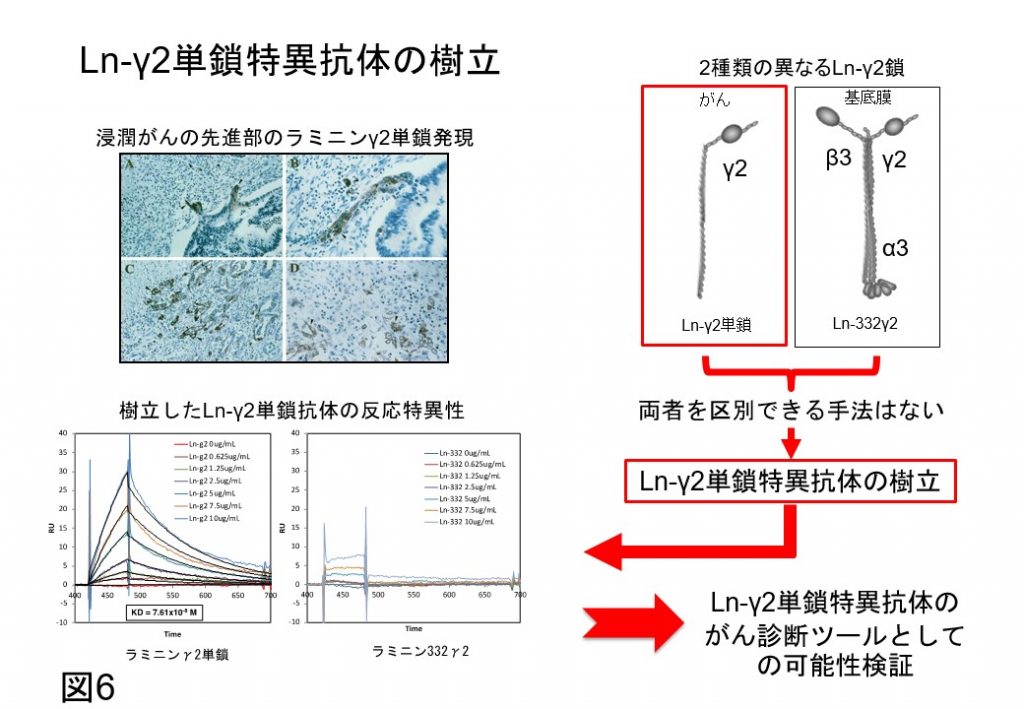
ラミニンγ2単鎖(Ln-γ2単鎖)は悪性がん細胞でのみ発現している細胞外マトリックス(ECM)として見出されました(Cancer Res 1999)(図6)。これまでに正常組織からのLn-γ2単鎖の発現は報告されていません。Ln-γ2単鎖はMT1-MMPのプロセシングを受けることで、EGF受容体のライガンドとして作用するEGF様断片を遊離し、がん細胞や周囲の微少環境の細胞のEGF受容体の活性化を介してがん悪性化進展を亢進します(JCB. 2000, JBC 2005)。そのため、見出した当時、Ln-γ2単鎖は浸潤性がんの新たな指標として大変に期待されましたが、臨床応用には至りませんでした。理由として、Ln-γ2単鎖は基底膜を形成するラミニン332の構成鎖として発現するLn-γ2鎖と同じ遺伝子を共有し、臨床応用に必須な蛋白質レベルで選択的にLn-γ2単鎖を認識できる抗体が存在しないことがあげられます。
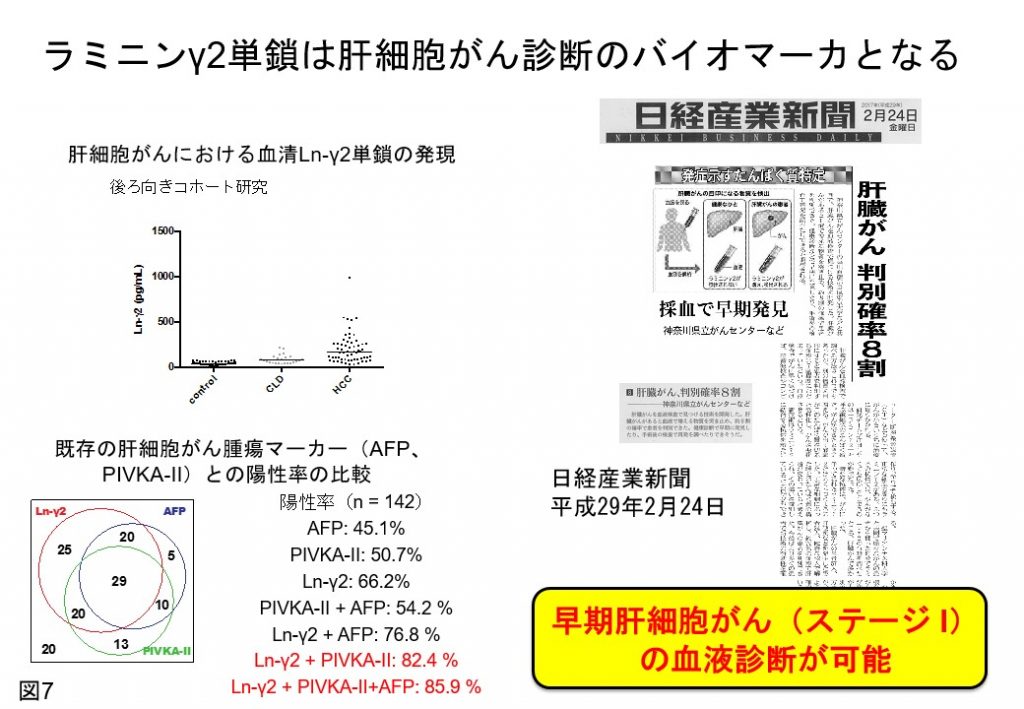
この問題を解決するため、Ln-γ2単鎖を選択的に認識できる特異抗体の樹立を行いました(Cancer Res 2008, 2016)(図6)。そこで、Ln-γ2単鎖特異抗体をがん血清免疫診断法に応用するための研究を進め、1)早期がんを含む膀胱がん患者尿にLn-γ2単鎖が高濃度に存在すること(Cancer Sci 2015)、2)有効な血清診断法のない膀胱がんを早期に見出す新たな診断指標になる可能性を見出しております(BMC Biomarker Res 2018)。また、血清Ln-γ2単鎖を指標とすることで、肝細胞がん診断に応用する可能性を見出しました(Cancer Sci 2017)(図7)。
現在、肝細胞がん発症、進展に及ぼすLn-γ2単鎖の作用を解明する目的で、肝細胞、遺伝子改変マウスを用いた基礎研究を進めると共に、国内外の大学病院と共同で血清Ln-γ2単鎖を肝がん、膀胱がんを早期診断するためのバイオマーカーとしての臨床性能を検証しています。
(3)逆相蛋白質アレイ(Reverse Phase Protein Array: RPPA)を用いた肝細胞がん悪性化進展制御の数理シミュレーション解析
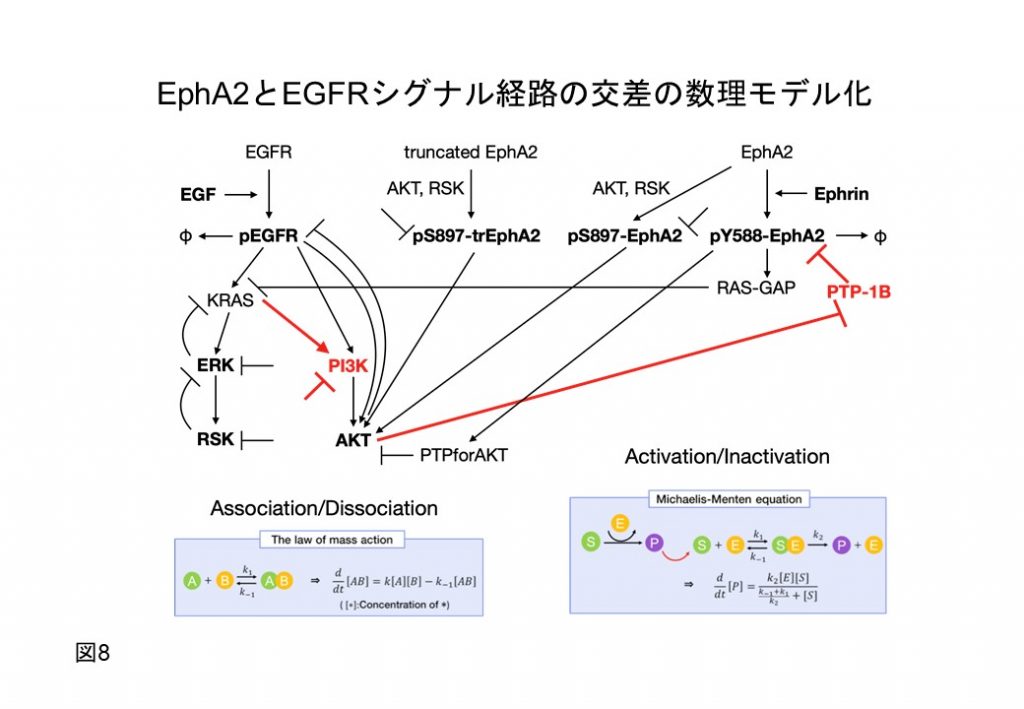
実験生物と数理科学の融合研究を円滑に進めるため、RPPAによる多次元時系列情報を基にした数理モデルを構築し、実験的に検出が困難ながん悪性化進展を制御する細胞シグナルの動態をシミュレーションによる予測を行っています。一例として、肝がんに高頻度で発現するチロシンキナーゼ受容体、EphA2、とその関連シグナル経路に着目した検討を行っています。EphA2はリガンドのEphrin-Aの存在の有無によりがん化の促進、抑制シグナルを細胞に伝えます。生体内で、これらEphA2シグナルの制御は明確になっていません。生物実験による従来の解析は、これらシグナルの限定的な一面を見ていることにとどまります。そこで、RPPA*を用いた多次元時系列でこれらシグナルを定量化し、それら情報を基にEphA2シグナル経路を数理モデルに表し(図8)、がん細胞のEphA2の相反したシグナルの経時的な変化をシミュレーションで可視化することで、生体内でのEphA2シグナル制御を予測し、その妥当性を生物実験で検証しています。以上より、生物学と数理学の技術融合によりこれまでの実験科学では不可視できなかったがん促進、抑制を担うシグナルの多次元時系列の変化を可視化することで、肝がんの悪性化の一端を担う分子メカニズムを解明してまいります。
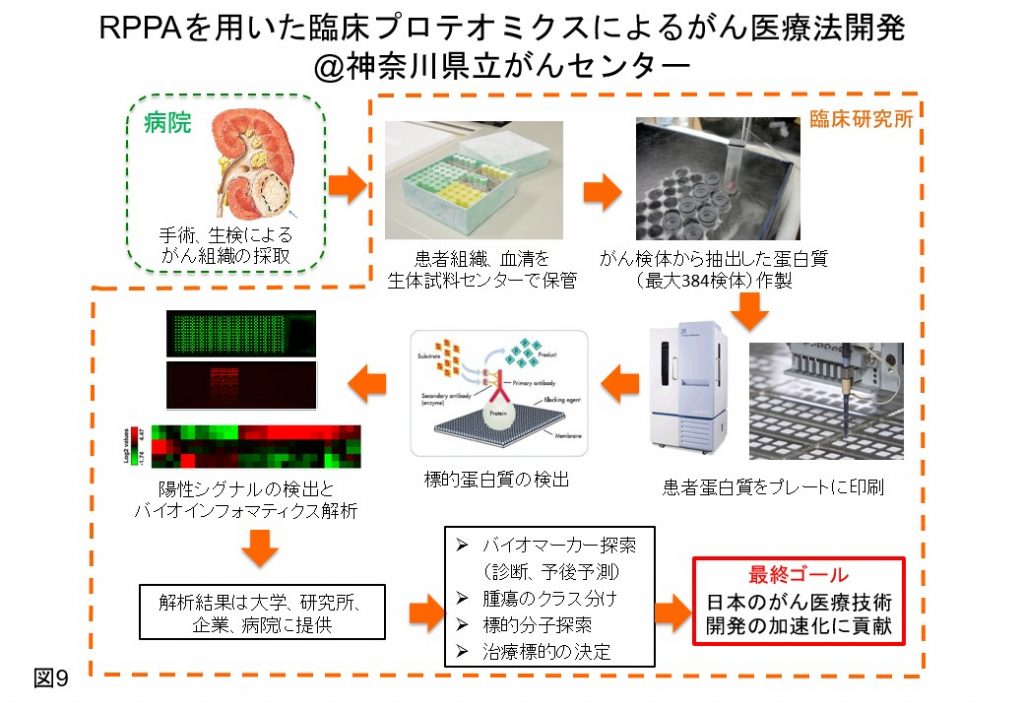
*逆相蛋白質アレイ(Reverse Phase Protein Array: RPPA)は、ウエスタンブロット(WB)に代わるハイスループットな細胞シグナルの多次元時系列解析法(図9)。これまでに、RPPA解析に使用できるがん悪性化進展を制御する膜蛋白質、細胞シグナル分子の抗体(約100種)のバリデーションを行い、従来のWBを越える高感度、ハイスループットなRPPA解析を確立した(Proteomics Clinical Appl 2019)。RPPA解析は神奈川県立がんセンター臨床研究所・臨床がんプロテオミクス研究室に設置しており、同研究室においてRPPA解析技術を提供できる環境整備を整えている。